modelos atómicos
Modelo atómico de Demócrito
(450 a. C.),
el primer modelo atómico, postulado por el filósofo griego Demócrito.
Esta era considerada como indivisible e indestructible, se la llamaba la
partícula más pequeña de la materia.
modelo atómico de dalton
- La materia está formada por partículas indivisibles, indestructibles y extremadamente pequeñas llamadas átomos
- Los átomos de un mismo elemento son idénticos entre sí (igual masa y propiedades)
- Los átomos de elementos distintos tienen diferente masa y propiedades
- Los compuestos están formados por la unión de átomos en proporciones constantes y simples
Limitaciones del Modelo Atómico de Dalton:
 |
Átomo indivisible
de Dalton |
Los átomos no
son partículas indivisibles ni inalterables, por lo cual este modelo no
puede explicar muchas propiedades de los elementos.
El Modelo
Atómico de Dalton fue sustituido por el Modelo Atómico de Thomson al
descubrir que los átomos no son indivisibles sino que están formados por
partículas de carga positiva y otras de carga negativa.
Modelo Atómico de Thomson:
- Descubre el electrón.
- En su modelo el átomo está formado por electrones de carga negativa incrustados en una esfera de carga positivacomo en un "pudin de pasas".
- Los electrones están repartidos de manera uniforme por todo el átomo
- El átomo es neutro de manera que las cargas negativas de los electrones se compensancon la carga positiva.
Modelo Atómico de Rutherford:
- En este modelo el átomo está formado por dos regiones: una corteza y un núcleo
- En la corteza del átomo se encuentran los electronesgirando a gran velocidad alrededor del núcleo
- El núcleo es una región pequeña que se encuentra en el centro del átomo que posee la carga positiva
- El núcleo posee la práctica totalidad de la masa del átomo
El Modelo Atómico de Bohr postula que:
- Los electrones describen órbitas circulares estables alrededor del núcleo del átomo sin radiar energía
- Los electrones solo
se pueden encontrar en ciertas órbitas (no todas las órbitas están
permitidas). La ditancia de la órbita al núcleo se determina según
el número cuántico n (n=1, n=2, n=3...):
- radio de la órbita (en Ångströms) → r = 0,529 ·n2
- Los electrones solo emiten
o absorben energía en los saltos entre órbitas. En dichos saltos se
emite o absorbe un fotón cuya energía es la diferencia de energía entre
ambos niveles determinada por la fórmula:
- Ea - Eb = h · v = h · (RM · [1/nb2 - 1/na2]

Modelo Atómico de Sommerfeld:
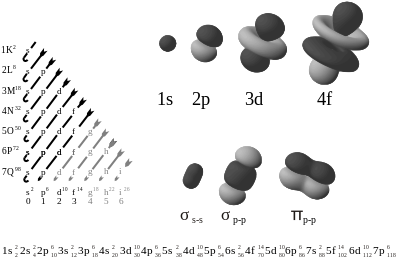
El Modelo Atómico de Sommerfeld postula que:
- Dentro de un mismo nivel energético (n) existen subniveles diferentes.
- No
solo existen órbitas circulares sino también órbitas
elípticas determinadas por el número cuántico azimutal (l) que toma
valores desde 0 a n-1:
- l = 0 → forma el orbital s
- l = 1 → forma el orbital p
- l = 2 → forma el orbital d
- l = 3 → forma el orbital f
- Adapta el modelo de Bohr a la mecánica relativista ya que los electrones se mueven a velocidades cercanas a las de la luz.
- Para Sommerfeld, el electrón es una corriente eléctrica

Modelo Atómico de Schrödinger:
- los electrones se distribuyen en orbitales que son regiones del espacio con una alta probabilidad de encontrar un electrón.
- Se tienen en cuenta los siguientes números cuánticos:
- Número cuántico principal (n)
- Número cuántico secundario o Azimutal (l)
- Número cuántico magnético (m)
- Número de espín (s)
- En un átomo no puede haber electrones con los cuatro números cuánticos iguales