EN ESTA OCASION SE TRABAJO EN EL LABORATORIO SOBRE LAS REACCIONES QUIMICAS.
TAMBIEN SE TRABAJO UN TALLER DE BALANCEO POR REDOX.
lunes, 20 de agosto de 2018
miércoles, 15 de agosto de 2018
SEMANA #26
En esta ocasión vimos el revelado de negativo y positivo de fotografías, algo que el profesor nos puso a consultar.
En negativo se mete a un tanque con un predeterminado de agua a 20 grados, luego se mete el revelador en el tanque, luego se agita durante 10 segundos cada minuto y luego se retira el revelador.
En positivo es similar pero con diferencias en los tiempos de procesado, se obtiene la imagen a partir del negativo sobre un soporte.
Luego de esto realizamos una actividad inicial.
luego de esto empezamos a aplicar la pureza a los problemas estequiometricos vistos anteriormente.
Si se parte de 200g de Mn(NO3)2 al 90% de pureza y 300g al 60% de pureza de HNO3, calcular:
a. RL
b. Xg y Xn HMnO4
c. cuantos gramos y moles de reactivo en exceso.
Pm = Mn(NO3)2 = 179g/mol
Pm = HNO3 = 63g/mol
200gMn(NO3)2 * 0,9 = 180g
300gHNO3 * 0,6 = 180g
nHNO3 = 180g/63g/mol
nMn(NO3)2 = 180g/179g/mol = 1,0 molMn(NO3)2
RL = 2,85/16 = 0,17
RL = 1/2 = 0,5
RL = 0,17
180g Xg
----------- -----------
16HNO3 -> 2HMnO4
----------- ------------
(16)63g/mol 240g/mol
----------
1008g/mol
XgHMnO4 = 180gHNO3 * 240gHMnO4/1008gHNO3
42,85gHMnO4
nHMNO4 = 42,8gHMnO4/120g/molHMNO4 = 0,35nHMnO4
lunes, 6 de agosto de 2018
SEMANA #25
Realizamos una actividad inicial que consistió en lo siguiente:
Buscar un número de 5 cifras que se lea al derecho igual que al revés y que dividido 7 de un número de la primera mitad del siglo 20.
13531: tiene 5 cifras, se lee al derecho y al revés igual, dividido 7 da 1933.
En esta ocación el profesor Alí nos llevo al laboratorio a realizar experimentalmente algunas Rx Qcas.
Combustión, Sustitución, Redox, Descomposición.
C2H5OH + O2 -> CO2 + H2O + E.
Etanol.
C70H142+ O2 -> CO2 + H2O + E
-> CO + H2O + E
-> C + H2O + E
HCl + Zn -> H2(g) + ZnCl2
Lo primero que vimos fue la electrólisis del agua, para esto usamos un voltametro de Hofmann, un regulador de voltaje, y un soporte universal,
Lo siguiente que hicimos fue conectar los 2 extremos del voltametro al regulador y darle energía eléctrica, lo que vimos después de unos minutos fue la electrolisis del agua en si, vimos como los elementos del agua hidrógeno y oxígeno se separaban uno de otro, el agua se convirtió en ambos gases separados.
También vimos otra reacción, un cambio de color.
Para esto usamos un alambre de cobre y un beaker.
vertimos cristales de plata en agua, luego en otro recipiente pusimos cobre y los combinamos, lo que vimos fue un claro ejemplo de sustitución.
AgNO3/H2O + Cu -> Ag + CuNO3
también apreciamos como el cobre cambió a color negro.
Buscar un número de 5 cifras que se lea al derecho igual que al revés y que dividido 7 de un número de la primera mitad del siglo 20.
13531: tiene 5 cifras, se lee al derecho y al revés igual, dividido 7 da 1933.
En esta ocación el profesor Alí nos llevo al laboratorio a realizar experimentalmente algunas Rx Qcas.
Combustión, Sustitución, Redox, Descomposición.
C2H5OH + O2 -> CO2 + H2O + E.
Etanol.
C70H142+ O2 -> CO2 + H2O + E
-> CO + H2O + E
-> C + H2O + E
HCl + Zn -> H2(g) + ZnCl2
Lo primero que vimos fue la electrólisis del agua, para esto usamos un voltametro de Hofmann, un regulador de voltaje, y un soporte universal,
Lo siguiente que hicimos fue conectar los 2 extremos del voltametro al regulador y darle energía eléctrica, lo que vimos después de unos minutos fue la electrolisis del agua en si, vimos como los elementos del agua hidrógeno y oxígeno se separaban uno de otro, el agua se convirtió en ambos gases separados.
También vimos otra reacción, un cambio de color.
Para esto usamos un alambre de cobre y un beaker.
vertimos cristales de plata en agua, luego en otro recipiente pusimos cobre y los combinamos, lo que vimos fue un claro ejemplo de sustitución.
AgNO3/H2O + Cu -> Ag + CuNO3
también apreciamos como el cobre cambió a color negro.
lunes, 30 de julio de 2018
SEMANA #24
Vimos los sgt conceptos:
ARDE: El agente reductor(el que dona e)
AGOTE: El agente oxidante es el que toma e
H2 + O2 -> H2O
O=AGOTE; H=ARDE
Si en un mismo compuesto un átomo pierde y otro gana electrones, se restan y se coloca la dirección del mayor, si estan en la misma dirección, se suman.
Si en una ecuación, existe una sustancia oxidada y otra reducida, la ecuación es de óxido reducción, es decir, cuando los estados de oxidación en reactivos y productos no son iguales.
Realizamos algunas ecuaciones para balancear por redox.
6Cl2 + 6KOH -> 5KCl + 1KClO3 + 3H2O
----- ---------
1e 5e
ARDE: El agente reductor(el que dona e)
AGOTE: El agente oxidante es el que toma e
H2 + O2 -> H2O
O=AGOTE; H=ARDE
Si en un mismo compuesto un átomo pierde y otro gana electrones, se restan y se coloca la dirección del mayor, si estan en la misma dirección, se suman.
Si en una ecuación, existe una sustancia oxidada y otra reducida, la ecuación es de óxido reducción, es decir, cuando los estados de oxidación en reactivos y productos no son iguales.
Realizamos algunas ecuaciones para balancear por redox.
6Cl2 + 6KOH -> 5KCl + 1KClO3 + 3H2O
----- ---------
1e 5e
6K = 6K
6Cl =6Cl
6H = 6H
6O = 6O
lunes, 23 de julio de 2018
SEMANA #23
Balanceo por Redox.
El profesor nos puso a consultar el balanceo por redox antes de empezar la clase.
El balanceo por redox es un método para balancear una ecuación química que simplifica la dificultad de esto, para realizar balanceo por redox, se siguen los sgt pasos.
1. Se asigna los estados de oxidación a cada elemento de la ecuación, en caso de que el elemento este solo, tiene estado de oxidación 0.
0 0 +1 -2
H2 + O2 -> H2O
2. Se identifica cual elemento se oxida y cual se reduce, para esto, se ve en los reactivos cuales estados de oxidación cambian, en el caso del hidrógeno, pasa de 0 a +1 osea que se oxida, pierde electrones, y en este caso 1, lo mismo para el oxígeno, pero en este caso se reduce, osea que gana.
0 0 +1 -1
H2 + O2 -> H2O
--- ---
1e 2e
--- ---
2e 4e (en caso de que hallan varios átomos, se multiplican esos electrones por ese número de átomos)
3. Luego que intercambian esos números, y se balancea por tanteo:
0 0 +1 -1
4H2 + 2O2 -> H2O
0 0 +1 -1
4H2 + 2O2 -> 4H2O
Hicimos una actividad inicial antes de empezar con todo.
Para los que digan que si Dios es omnipotente, porque dejo que el mal existierá, porque Dios puede crear a los seres vivos, pero es decisión de los seres vivos que Dios este o no en sus corazones.
Luego de esto, el profesor Alí nos dio un pequeño repaso de lo que consultamos, luego de esto nos dijo como ubicar los estados de oxidación en los elementos.
Para esto se tiene que tener en cuenta la siguiente regla, la suma-resta de los estados de oxidación, debe dar 0.
+1 +6 -2 = +2 +12 -14 = 0
K2Cr2O7
Siempre que pongamos estos estados de oxidación, los debemos multiplicar por la cantidad de átomos que tenga el elemento, y que el resultado, sumado y restado con los demás, de 0
El profesor nos puso a consultar el balanceo por redox antes de empezar la clase.
El balanceo por redox es un método para balancear una ecuación química que simplifica la dificultad de esto, para realizar balanceo por redox, se siguen los sgt pasos.
1. Se asigna los estados de oxidación a cada elemento de la ecuación, en caso de que el elemento este solo, tiene estado de oxidación 0.
0 0 +1 -2
H2 + O2 -> H2O
2. Se identifica cual elemento se oxida y cual se reduce, para esto, se ve en los reactivos cuales estados de oxidación cambian, en el caso del hidrógeno, pasa de 0 a +1 osea que se oxida, pierde electrones, y en este caso 1, lo mismo para el oxígeno, pero en este caso se reduce, osea que gana.
0 0 +1 -1
H2 + O2 -> H2O
--- ---
1e 2e
--- ---
2e 4e (en caso de que hallan varios átomos, se multiplican esos electrones por ese número de átomos)
3. Luego que intercambian esos números, y se balancea por tanteo:
0 0 +1 -1
4H2 + 2O2 -> H2O
0 0 +1 -1
4H2 + 2O2 -> 4H2O
Hicimos una actividad inicial antes de empezar con todo.
¿Qué existe y que no?
El mal que existe no es creado por Dios, es la ausencia de Dios.Para los que digan que si Dios es omnipotente, porque dejo que el mal existierá, porque Dios puede crear a los seres vivos, pero es decisión de los seres vivos que Dios este o no en sus corazones.
Luego de esto, el profesor Alí nos dio un pequeño repaso de lo que consultamos, luego de esto nos dijo como ubicar los estados de oxidación en los elementos.
Para esto se tiene que tener en cuenta la siguiente regla, la suma-resta de los estados de oxidación, debe dar 0.
+1 +6 -2 = +2 +12 -14 = 0
K2Cr2O7
Siempre que pongamos estos estados de oxidación, los debemos multiplicar por la cantidad de átomos que tenga el elemento, y que el resultado, sumado y restado con los demás, de 0
lunes, 9 de julio de 2018
SEMANA #21
Durante este comienzo de periodo, empezamos a ver la estequiometría, como tema del periodo pero antes realizamos una actividad inicial.
Hallar los valores de A, B, C, D, en la siguiente operación:
A B C D
A B C
A B
A
-----------
1 9 9 0
A = 1 B = 7 C = 9 D = 3
1 7 9 3
1 7 9
1 7
1
-----------
1 9 9 0
La Estequiometría.
La estequiometría es la parte de la química que se encarga de hacer los cálculos químicos en una o varias ecuaciones químicas. Sirve más que todo para plantearse problema como:
¿Qué cantidad de producto se obtiene a partir de una cantidad de reactivo?
Se usa para saber que cantidades son necesarias en una ecuación química, como encontrar una de estas, como balancear estas cantidades y como saber cuantas de estas sobran o limitan.
aA + bB = cC Rx Qca
Las ecuaciones estequiometricas pueden ser reversibles o irreversibles, es decir, que se el producto se puede pasar a reactivos separados otra vez, o no.
2H2 + O2 = 2H2O -> Reversible
C3H8 + 5O2 -> 3CO2 + 4H2O + E -> Irreversible
Interpretación de una Rx Qca
Podemos interpretar una reacción o ecuación química en moles, moléculas, átomos y gramos.
Ejemplo:
N2+ 3H = 2NH3
moles: 1mol + 3moles -> 2 moles
moléculas: 1molécula + 3moléculas -> 2moléculas
átomos: 2átomos + 6átomos -> 8átomos
gramos: 28gr + 6gr -> 34 gr
Es así como se puede interpretar una ecuación química en estas 4 variantes, se coloca la ecuación igual pero en vez de los elementos, se coloca la cantidad de variante que representa cada uno de los elementos.
Factores de conversión.
Estos factores se usan para poder interpretar una determinada cantidad expresada en una unidad, en otra unidad.
cuantos centímetros hay en 1,8m?
1m = 100cm (1m/100cm) o (100cm/1m)
(3molH2/1molN2) o (1molN2/3molH2)
(1molN2/2molNH3) o (1molNH3/1molN2)
(3molH2/2molNH3) o (2molNH3/3molH2)
También consultamos algunos tipos de reacciones Qcas:
Reacciones exótermicas.
Son aquellas las cuales desprenden energía en forma de calor o luz, las que liberan energía.
Reacciones endotérmicas.
Al contrario de la anterior, estas absorben energía en forma de calor, la energía de los productos es mayor a la de los reactivos, absorbe energía para poder llevar acabo la reacción.
Reacción exoluminosa.
Son aquellas que liberan luz cuando se llevan acabo, o la manifiestan.
Reacción endoluminosa.
Son aquellas que necesitan energía luminíca para llevarse acabo.
Reacciones endoeléctricas.
Son aquellas reacciones que requieren el aporte de energía eléctrica para llevarse acabo.
lunes, 5 de marzo de 2018
SEMANA #8
ESAT SEMANA SE TRABAJO EL TEMA DE LOS ENLACES COVALENTES NOS PUSO UNA CONSULTA.
ENLACES COVALENTES
Un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para alcanzar el octeto estable, compartiendo electrones del último nivel1 (excepto el hidrógeno que alcanza la estabilidad cuando tiene 2 electrones). La diferencia de electronegatividad entre los átomos no es lo suficientemente grande como para que se produzca una unión de tipo iónica. Para que un enlace covalente se genere es necesario que la diferencia de electronegatividad entre átomos sea menor a 1,7.
De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se producen entre átomos de un mismo elemento no metal, entre distintos no metales y entre un no metal y el hidrógeno.34
Cuando átomos distintos de no metales se unen en una forma covalente, uno de ellos resultará más electronegativo que el otro, por lo que tenderá a atraer la nube electrónica del enlace hacia su núcleo, generando un dipolo eléctrico.5 Esta polarización permite que las moléculas del mismo compuesto se atraigan entre sí por fuerzas electrostáticas de distinta intensidad.
Por el contrario, cuando átomos de un mismo elemento no metálico se unen covalentemente, su diferencia de electronegatividad es cero y no se crean dipolos. Las moléculas entre sí poseen prácticamente una atracción nula.
En síntesis, en un enlace iónico, se produce la transferencia de electrones de un átomo a otro y en el enlace covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir, se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos pueden compartirse uno, dos o tres pares de electrones, lo cual dará lugar a la formación de un enlace simple, doble o triple respectivamente. En la estructura de Lewis, estos enlaces pueden representarse por una pequeña línea entre los átomos.
 Los primeros conceptos de la unión covalente surgieron de este tipo de imagen de la molécula de carbono e hidrógeno. El enlace covalente está implícito en la estructura de Lewis indicando electrones compartidos entre los átomos.
Los primeros conceptos de la unión covalente surgieron de este tipo de imagen de la molécula de carbono e hidrógeno. El enlace covalente está implícito en la estructura de Lewis indicando electrones compartidos entre los átomos.
ENLACES COVALENTES
Un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para alcanzar el octeto estable, compartiendo electrones del último nivel1 (excepto el hidrógeno que alcanza la estabilidad cuando tiene 2 electrones). La diferencia de electronegatividad entre los átomos no es lo suficientemente grande como para que se produzca una unión de tipo iónica. Para que un enlace covalente se genere es necesario que la diferencia de electronegatividad entre átomos sea menor a 1,7.
De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se producen entre átomos de un mismo elemento no metal, entre distintos no metales y entre un no metal y el hidrógeno.34
Cuando átomos distintos de no metales se unen en una forma covalente, uno de ellos resultará más electronegativo que el otro, por lo que tenderá a atraer la nube electrónica del enlace hacia su núcleo, generando un dipolo eléctrico.5 Esta polarización permite que las moléculas del mismo compuesto se atraigan entre sí por fuerzas electrostáticas de distinta intensidad.
Por el contrario, cuando átomos de un mismo elemento no metálico se unen covalentemente, su diferencia de electronegatividad es cero y no se crean dipolos. Las moléculas entre sí poseen prácticamente una atracción nula.
En síntesis, en un enlace iónico, se produce la transferencia de electrones de un átomo a otro y en el enlace covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir, se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos pueden compartirse uno, dos o tres pares de electrones, lo cual dará lugar a la formación de un enlace simple, doble o triple respectivamente. En la estructura de Lewis, estos enlaces pueden representarse por una pequeña línea entre los átomos.
 Los primeros conceptos de la unión covalente surgieron de este tipo de imagen de la molécula de carbono e hidrógeno. El enlace covalente está implícito en la estructura de Lewis indicando electrones compartidos entre los átomos.
Los primeros conceptos de la unión covalente surgieron de este tipo de imagen de la molécula de carbono e hidrógeno. El enlace covalente está implícito en la estructura de Lewis indicando electrones compartidos entre los átomos.lunes, 26 de febrero de 2018
SEMANA #7
esta semana hicimos la actividad inicial de el puente de vidrio ubicado en china que es un sitio turistico.
tambien hicmos toda la introduccion al tema de los atomos desde el primer modelo hasta el modelo actual.
se explicaron las partes del atomo quien las habia descubierto,como, en que año y todo lo relacionado com este.
tambien empezamos a ver el tema de distribucion electronica.
PUENTE DE CRISTAL

ESTA ES UNA CREACION QUE DEMUESTRA TODAS LAS CAPACIDADES DEL HOMBRE Y COMO SON CAPACES DE SUPERAR LAS ADVERSIDAES Y EL MIEDO AL CONSTRUIR ESTE PUENTE SOBRE EL GRAN ABISMO.
CONFIGURACION ELECTRONICA
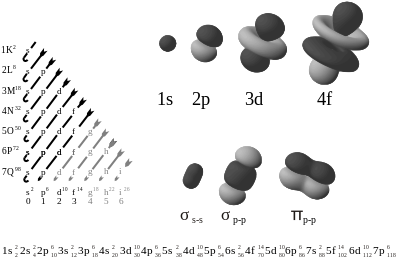
En química, la configuración electrónica indica la manera en la cual los electrones se estructuran, comunican u organizan en un átomo de acuerdo con el modelo de capas electrónicas, en el cuál las funciones de ondas del sistema se expresa como un átomo o atómicamente un producto de orbitales antisimetrizadas. La configuración electrónica es importante porque determina las propiedades de combinación química de los átomos y por tanto su posición en la tabla periódica.


tambien hicmos toda la introduccion al tema de los atomos desde el primer modelo hasta el modelo actual.
se explicaron las partes del atomo quien las habia descubierto,como, en que año y todo lo relacionado com este.
tambien empezamos a ver el tema de distribucion electronica.
PUENTE DE CRISTAL

ESTA ES UNA CREACION QUE DEMUESTRA TODAS LAS CAPACIDADES DEL HOMBRE Y COMO SON CAPACES DE SUPERAR LAS ADVERSIDAES Y EL MIEDO AL CONSTRUIR ESTE PUENTE SOBRE EL GRAN ABISMO.
CONFIGURACION ELECTRONICA
En química, la configuración electrónica indica la manera en la cual los electrones se estructuran, comunican u organizan en un átomo de acuerdo con el modelo de capas electrónicas, en el cuál las funciones de ondas del sistema se expresa como un átomo o atómicamente un producto de orbitales antisimetrizadas. La configuración electrónica es importante porque determina las propiedades de combinación química de los átomos y por tanto su posición en la tabla periódica.



viernes, 23 de febrero de 2018
SEMANA #6
modelos atómicos
Modelo atómico de Demócrito
(450 a. C.), el primer modelo atómico, postulado por el filósofo griego Demócrito. Esta era considerada como indivisible e indestructible, se la llamaba la partícula más pequeña de la materia.

Los átomos no
son partículas indivisibles ni inalterables, por lo cual este modelo no
puede explicar muchas propiedades de los elementos.

Modelo Atómico de Thomson:
Modelo Atómico de Rutherford:
Modelo atómico de Demócrito
(450 a. C.), el primer modelo atómico, postulado por el filósofo griego Demócrito. Esta era considerada como indivisible e indestructible, se la llamaba la partícula más pequeña de la materia.
modelo atómico de dalton
- La materia está formada por partículas indivisibles, indestructibles y extremadamente pequeñas llamadas átomos
- Los átomos de un mismo elemento son idénticos entre sí (igual masa y propiedades)
- Los átomos de elementos distintos tienen diferente masa y propiedades
- Los compuestos están formados por la unión de átomos en proporciones constantes y simples
 |
| Átomo indivisible de Dalton |
El Modelo
Atómico de Dalton fue sustituido por el Modelo Atómico de Thomson al
descubrir que los átomos no son indivisibles sino que están formados por
partículas de carga positiva y otras de carga negativa.

- Descubre el electrón.
- En su modelo el átomo está formado por electrones de carga negativa incrustados en una esfera de carga positivacomo en un "pudin de pasas".
- Los electrones están repartidos de manera uniforme por todo el átomo
- El átomo es neutro de manera que las cargas negativas de los electrones se compensancon la carga positiva.

- En este modelo el átomo está formado por dos regiones: una corteza y un núcleo
- En la corteza del átomo se encuentran los electronesgirando a gran velocidad alrededor del núcleo
- El núcleo es una región pequeña que se encuentra en el centro del átomo que posee la carga positiva
- El núcleo posee la práctica totalidad de la masa del átomo
El Modelo Atómico de Bohr postula que:
- Los electrones describen órbitas circulares estables alrededor del núcleo del átomo sin radiar energía
- Los electrones solo se pueden encontrar en ciertas órbitas (no todas las órbitas están permitidas). La ditancia de la órbita al núcleo se determina según el número cuántico n (n=1, n=2, n=3...):
- radio de la órbita (en Ångströms) → r = 0,529 ·n2
- Los electrones solo emiten o absorben energía en los saltos entre órbitas. En dichos saltos se emite o absorbe un fotón cuya energía es la diferencia de energía entre ambos niveles determinada por la fórmula:
- Ea - Eb = h · v = h · (RM · [1/nb2 - 1/na2]

Modelo Atómico de Sommerfeld:
El Modelo Atómico de Sommerfeld postula que:
- Dentro de un mismo nivel energético (n) existen subniveles diferentes.
- No solo existen órbitas circulares sino también órbitas elípticas determinadas por el número cuántico azimutal (l) que toma valores desde 0 a n-1:
- l = 0 → forma el orbital s
- l = 1 → forma el orbital p
- l = 2 → forma el orbital d
- l = 3 → forma el orbital f
- ...
- Adapta el modelo de Bohr a la mecánica relativista ya que los electrones se mueven a velocidades cercanas a las de la luz.
- Para Sommerfeld, el electrón es una corriente eléctrica

Modelo Atómico de Schrödinger:
- los electrones son ondas de materia que se distribuyen en el espacio según la función de ondas (Ψ):(δ2Ψ/δx2) + (δ2Ψ/δy2) + (δ2Ψ/δz2) + (8π2m/h2)(E-V)Ψ = 0
- los electrones se distribuyen en orbitales que son regiones del espacio con una alta probabilidad de encontrar un electrón.
- Se tienen en cuenta los siguientes números cuánticos:
- Número cuántico principal (n)
- Número cuántico secundario o Azimutal (l)
- Número cuántico magnético (m)
- Número de espín (s)
- En un átomo no puede haber electrones con los cuatro números cuánticos iguales

miércoles, 14 de febrero de 2018
lunes, 5 de febrero de 2018
SEMANA #4
esta semana hicimos la reflexión de el morir del padre gonzalo gallo gonzales.
empezamos con las propiedades de la materia como volumen,densidad,masa,peso,temperatura con sus definiciones y formulas.
también hicimos una pequeña actividad interactiva de arquimedes.
y em,pezamos a ver las unidades químicas tales como la umas ,ato-gramo,mol,masa molar,y hicimos aplicaciones de estas.

empezamos con las propiedades de la materia como volumen,densidad,masa,peso,temperatura con sus definiciones y formulas.
también hicimos una pequeña actividad interactiva de arquimedes.
y em,pezamos a ver las unidades químicas tales como la umas ,ato-gramo,mol,masa molar,y hicimos aplicaciones de estas.

lunes, 29 de enero de 2018
SEMANA #3
esta semana trabajamos con las propiedades de la materia vimos que es materia y empezamos con las propiedades de esta tambien hicimos una consulta sobre las ramas de la química.
lunes, 22 de enero de 2018
SEMANA#2
esta semana trabajamos los estados de la materia con sus propiedades,ejemplos,nombres,etc. ademas tuvimos que consultar sobre las ramas de la química.
Ademas hicimos la actividad inicial de adriana macias que es un claro ejemplo de superación personal.
Ademas hicimos la actividad inicial de adriana macias que es un claro ejemplo de superación personal.
lunes, 15 de enero de 2018
SEMANA #1
esta semana hicimos la presentación y vimos los contenidos a trabajar durante el periodo.
también vimos la historia de la materia sus clasificaciones y descripciones de cada una.ademas hablamos de la energía y sus partes.
VOKI: CLICK AQUI
también vimos la historia de la materia sus clasificaciones y descripciones de cada una.ademas hablamos de la energía y sus partes.
VOKI: CLICK AQUI
Suscribirse a:
Comentarios (Atom)
